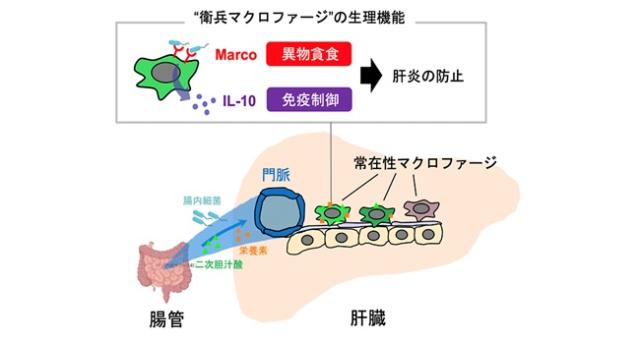
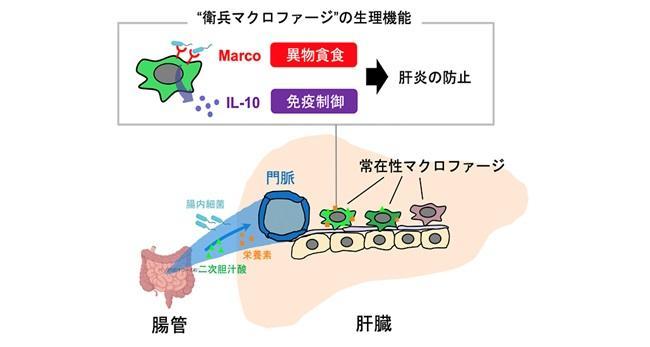
大阪大学大学院医学系研究科の宮本佑 特任研究員(常勤)(免疫細胞生物学)、石井優 教授(免疫細胞生物学、医薬基盤・健康・栄養研究所創薬イメージングプロジェクトリーダー)らの研究グループは、肝臓の入り口付近に分布する一部の常在性マクロファージ※1が腸管から入ってくる腸内細菌やその関連物質から肝臓を保護していることを明らかにしました(図1)。
図1 門脈近傍に分布する“衛兵マクロファージ”は、病原体を貪食消化しつつ周囲の炎症を抑制することで肝臓の恒常性を維持する。
ニュース概要
【研究成果のポイント】
◆肝臓の生体イメージングと組織内の空間情報を保持した遺伝子発現解析により、肝臓における“衛兵マクロファージ”を同定した。
◆この“衛兵マクロファージ”が腸内細菌の侵入による炎症から肝臓を保護すること、腸内細菌がつくるイソアロリトコール酸が肝臓の“衛兵マクロファージ”を誘導することを解明した。
◆イソアロリトコール酸を用いて“衛兵マクロファージ”を誘導することで肝臓の炎症を予防・治療する新しい医療技術の開発が期待される。
肝臓には、腸管で吸収された栄養素の他に、腸内細菌やその関連物質がしばしば入ってきます。通常の肝臓ではこのような炎症誘導性の刺激に対して免疫系が過度に反応しないように制御されていますが、そのメカニズムはよくわかっていませんでした。
今回の研究では、肝臓の生体イメージングによる炎症細胞の動態解析技術と組織内の位置情報を保持した1細胞遺伝子発現解析技術を独自に開発することで、肝臓の入り口付近に分布している“衛兵マクロファージ”が、腸管から入ってくる腸内細菌やその関連物質によって引き起こされる炎症から肝臓を保護していることを解明しました。さらに、一部の腸内細菌が産生する二次胆汁酸※2のイソアロリトコール酸が“衛兵マクロファージ”を誘導することを明らかにしました。今後、イソアロリトコール酸を用いて肝臓内の“衛兵マクロファージ”を増やすことで、肝臓の炎症を防ぐ新しい予防・治療薬の開発が期待されます。
本研究成果は、英国科学誌「Nature」に、4月25日(木)0時(日本時間)に公開されます。
研究の背景
肝臓と腸管は門脈と呼ばれる血管を介して直結しており、腸管で取り込まれた栄養素はこの門脈を通じて直接肝臓に運ばれます。腸管には多数の腸内細菌が生息しており、腸内細菌やその関連物質もしばしば門脈を通じて肝臓に入ってきます。特に、潰瘍性大腸炎やリーキーガット※3症候群のように腸管のバリア機能が低下した状態では、多くの腸内細菌や関連物質が肝臓に入ってきて炎症性の病態を引き起こすことがあります。健常な肝臓では、侵入してきた腸内細菌や関連物質を迅速に処理し炎症を防ぐことができますが、肝臓内のどの細胞がどこで、どのように炎症を防いでいるのかについてはよくわかっていませんでした。
研究の内容
肝臓の生体イメージング技術を独自に確立し、肝臓の入り口となる門脈(PV)付近の領域(門脈域)と肝血流の出口となる中心静脈(CV)付近の領域における炎症反応を比較したところ、門脈域では炎症反応が抑制されていることを発見しました。さらに、それぞれの領域に存在する細胞を蛍光標識して回収する技術を新たに確立し、各領域の細胞を1細胞ずつ遺伝子発現解析したところ、スカベンジャー受容体※4であるマルコ(Marco)と抗炎症性サイトカイン※5であるインターロイキン-10(IL-10)を高発現する常在性マクロファージが門脈域に局在していることが明らかになりました。このMarcoの機能を調べたところ、細菌を捕食する機能やIL-10の発現を増大させる機能をもつことが明らかになりました。続いて、リーキーガットを誘発し、野生型マウスとMarco欠損マウスを用いて、バリア機能を低下させた状態で肝臓内の炎症を比較する実験を行いました。Marco欠損マウスでは、野生型マウスよりも多くの炎症細胞が肝臓に浸潤しており(図2)、肝障害マーカーであるALT/ASTの濃度も高い値を示しました。加えて、Marco欠損マウスでは異常なコラーゲン線維の産生もみられました。
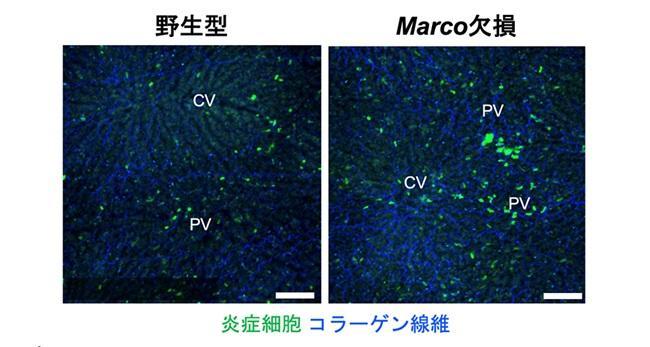
図2 リーキーガットにともなう肝内炎症
リーキーガットを誘導した野生型マウスおよびMarco欠損マウスの肝臓内の生体イメージング像。緑色:炎症細胞(好中球・マクロファージ)、青色:コラーゲン線維、PV:門脈、CV:中心静脈、スケールバー:100 µm。
これらは難病である原発性硬化性胆管炎(PSC)にみられる症状と似ているため、PSC患者さんから採取した肝臓の正常な部分とPSC部分を調べたところ、PSCの肝臓ではMarco発現マクロファージが顕著に減少していることが確認されました。以上のことから、このMarcoを発現するマクロファージが肝臓の入り口付近で侵入してきた細菌などを貪食処理し、周囲の炎症反応を抑えている“衛兵マクロファージ”であることが明らかになりました。
さらに、実験用マウスの飼育施設によってこのマクロファージの数が異なることを発見し、各施設のマウスを詳細に調べた結果、“衛兵マクロファージ”が多いマウスにはオドリバクター(Odoribacteraceae)という腸内細菌が存在することを突きとめました。Odoribacteraceaeは二次胆汁酸のイソアロリトコール酸を産生することが知られています。そこで、このイソアロリトコール酸をマウスに経口投与したところ、肝臓の常在性マクロファージにおけるMarcoとIL-10の発現が増大しました(図3)。以上の結果から、イソアロリトコール酸には“衛兵マクロファージ”を増やす能力があることが明らかになりました。
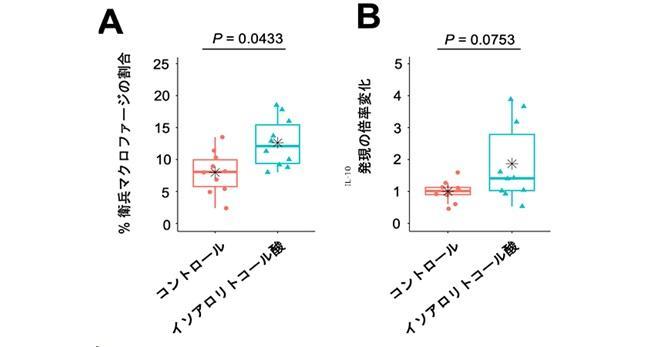
図3 イソアロリトコール酸による“衛兵マクロファージ”の誘導効果
イソアロリトコール酸またはDMSO(コントロール)を2週間経口投与した後の肝臓内のMarco発現マクロファージ(“衛兵マクロファージ”)の割合(A)と常在性マクロファージにおけるIL-10の発現変化(B)。
本研究成果が社会に与える影響(本研究成果の意義)
現代社会では、生活習慣の乱れや偏った食生活などによりリーキーガットになる人の数の増加が懸念されます。リーキーガットになると、肝臓をはじめ様々な臓器で炎症が惹起され身体の不調につながります。特に、リーキーガットとの関係が示唆される肝臓の慢性炎症疾患である代謝異常関連脂肪肝炎(MASH: Metabolic dysfunction-associated steatohepatitis)は近年増加の一途を辿っており、その治療が困難なことから大きな社会問題となっています。本研究により、肝臓内の“衛兵マクロファージ”による腸内細菌感染に対する生体防御機構が解明されたことで、今後このマクロファージの機能を高めることで、MASHを始めとする慢性肝炎の予防法および治療法の開発が期待されます。
特記事項
本研究成果は、2024年4月25日(木)0時(日本時間)に英国科学誌「Nature」のオンライン版で掲載されます。
タイトル:
“Periportal macrophages protect against commensal-driven liver inflammation”
著者名:
宮本佑1,2,3, 菊田順一1,2,3,4, 松井崇浩1,5 , 長谷川哲雄1 , 藤井健太郎1,2,3 , 奥崎大介2,6 , 劉祐誠2,6 , 吉岡拓哉7 , 瀬尾茂人8 , 元岡大祐2,6 , 内田穣1,2,3,4 , 山下英里華1,2,3 , 小林省吾9 , 江口英利9 , 森井英一5 , Karl Tryggvason10, 七田祟11 , 香山尚子2,12 , 新幸二13 , 國澤純7 , 本田賢也13 ,竹田潔2,12 , 石井優1,2,3,4*(*責任著者)
所属:
1. 大阪大学 大学院医学系研究科・生命機能研究科 免疫細胞生物学
2. 大阪大学 免疫学フロンティア研究センター
3. 大阪大学 先導的学際研究機構 ライフォミクス統合研究部門
4. 国立研究開発法人 医薬基盤・健康・栄養研究所 創薬イメージングプロジェクト
5. 大阪大学 大学院医学系研究科 病態病理学
6. 大阪大学 微生物病研究所 バイオインフォマティクスセンター
7. 国立研究開発法人 医薬基盤・健康・栄養研究所 ワクチンマテリアルプロジェクト
8. 大阪大学 大学院情報科学研究科 バイオ情報工学
9. 大阪大学 大学院医学系研究科 消化器外科学
10. シンガポール Duke-NUS Medical School
11. 東京医科歯科大学 難治疾患研究所 神経炎症修復学
12. 大阪大学 大学院医学系研究科 免疫制御学
13. 慶應義塾大学 医学部 微生物学・免疫学
DOI: 10.1038/s41586-024-07372-6
本研究は、科学技術振興機構(JST)戦略的創造研究推進事業CREST「統合1細胞解析のための革新的技術基盤」(JPMJCR15G1)、日本学術振興会科学研究費助成事業(19H05657、20H05901、22K21354、21J13888、22K20760)、日本医療研究開発機構(AMED)先端的バイオ創薬等基盤技術開発事業(JP21am0401009)・B型肝炎創薬実用化等研究事業(JP23fk0310512)、上原記念生命科学財団の支援を受けて行われました。
用語説明
※1 常在性マクロファージ
免疫細胞の一つで、病原体など異物を取り込んで細胞内で消化する機能をもつ。マクロファージは大きく2パターンの発生起源(胚由来、骨髄由来)があるとされ、肝臓の常在性マクロファージはほとんどが胚由来である。
※2 二次胆汁酸
肝臓でコレステロールから合成される一次胆汁酸(コール酸、ケノデオキシコール酸)が腸管に放出され、腸内細菌のはたらきにより変換された化合物。
※3 リーキーガット
腸管上皮細胞による物理的バリア機能が低下した状態。腸管上皮の透過性が上昇することで、腸管管腔内の未消化物、細菌、細菌由来物質などが入ってきやすくなる。腸管を通過したこれらの物質は門脈を経由して肝臓に運ばれる。
※4 スカベンジャー受容体
幅広い物質を認識し捕捉する受容体であり、マクロファージなどの食細胞や一部の内皮細胞に発現する。特に、脂質、死細胞から放出されるダメージ関連分子、外来微生物がもつ病原体関連分子などを認識することが知られる。
※5 抗炎症性サイトカイン
炎症反応を抑制する作用を持つサイトカイン。インターロイキン-10(IL-10)、インターロイキン-1受容体アンタゴニスト(IL1RN)、TGF-などが代表的な抗炎症性サイトカインとして知られる。適切なタイミングで産生されることで免疫応答を適度に調節している。